製薬分野における特許期間延長制度の徹底解説と戦略的実務対応
はじめに:製薬事業の生命線である特許期間
株式会社IPリッチのライセンス担当です。
本記事では、医薬品産業において極めて重要な意味を持つ「特許権の存続期間の延長登録制度」について、制度の全体像から実務上の留意点、最新の判例動向、そして海外制度との比較までを網羅的に解説します。医薬品開発には、基礎研究から承認取得まで10年以上の歳月と数百億円規模の投資が必要です。この莫大な先行投資を回収し、次の革新的な新薬を生み出すための原資を確保するには、特許による独占期間の確保が不可欠です。しかし、薬機法等の規制により、特許権を持っていても販売できない「空白の期間」が生じるのがこの業界の宿命です。本制度はその侵食された期間を回復させる唯一の手段であり、その活用如何で企業の収益構造は劇的に変化します。本稿が、知財戦略の構築に役立つ一助となれば幸いです。
知財の収益化と専門人材の重要性について
製薬企業における知財戦略は、単なる「権利の保護」にとどまらず、事業の根幹を支える「知財の収益化」そのものです。特に、今回取り上げる特許期間延長制度は、ブロックバスター(大型新薬)の独占販売期間を最大5年間延長できる可能性を持ち、その経済的価値は数百億円、場合によっては数千億円に達することもあります。1日の権利期間の喪失が巨額の機会損失につながるため、制度の精緻な理解と、開発部門と連携した緻密な戦略立案が求められます。このように、知財をコストセンターではなくプロフィットセンターとして捉え、収益最大化に貢献できる高度な知財人材の需要は、近年かつてないほど高まっています。
もし、貴社が即戦力となる優秀な知財人材の採用をお考えであれば、知財専門の求人プラットフォーム「PatentRevenue」のご活用を強くお勧めします。知財に特化した人材プールから、貴社の戦略に合致する専門家を見つけることが可能です。求人情報の登録は無料ですので、ぜひ一度ご覧ください( https://patent-revenue.iprich.jp/recruite/ )。
特許期間延長制度の基本的仕組みと期間計算の要点
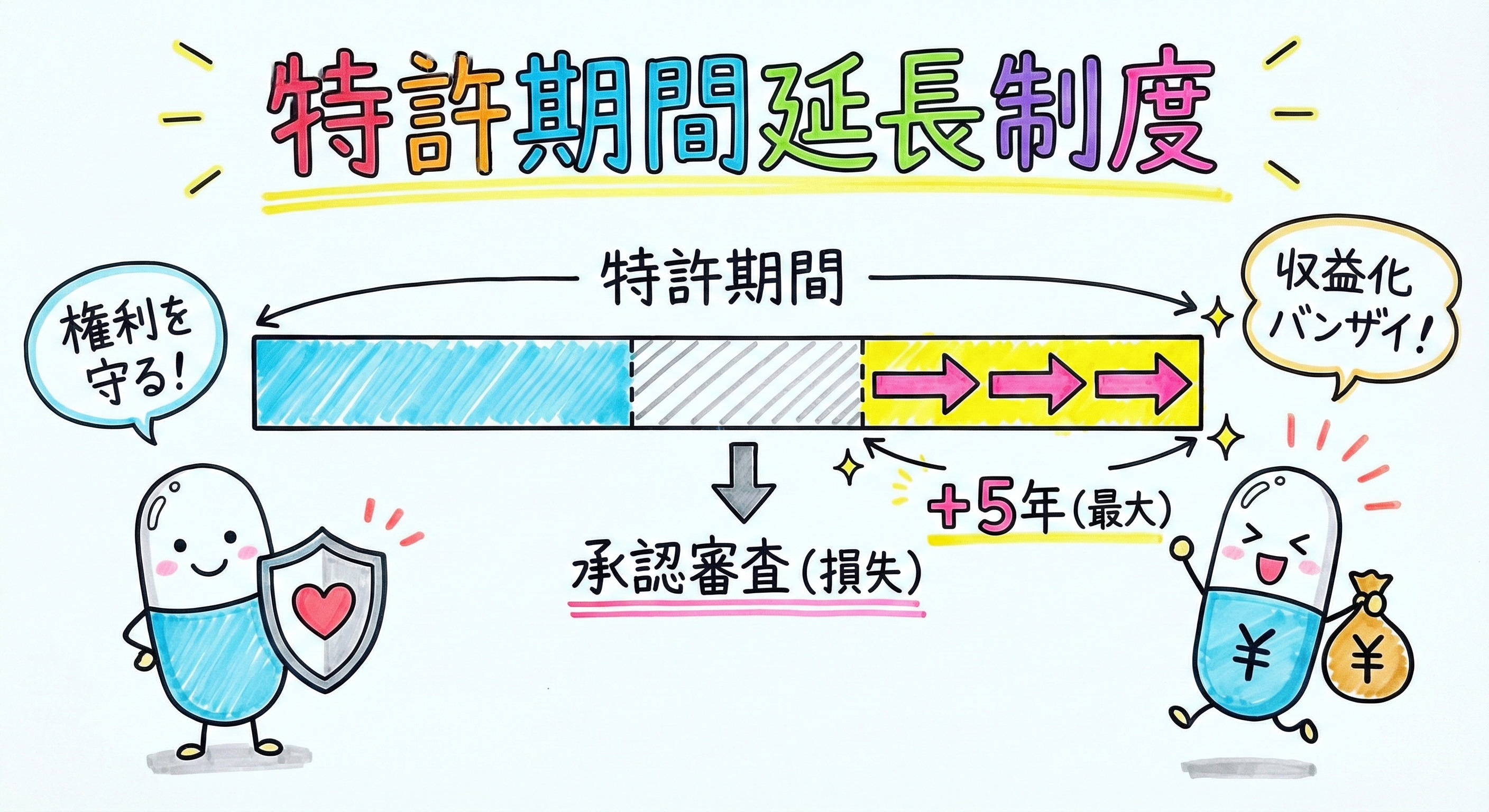
特許権の存続期間は、原則として出願日から20年で終了します。しかし、医薬品や農薬等の分野では、安全性や有効性を確認するための法規制(薬機法や農薬取締法など)に基づく審査に長期間を要し、その間は特許発明を実施(製造・販売)できないという特有の事情があります。この「実施できなかった期間」を補償するために設けられているのが、特許法第67条に基づく存続期間の延長登録制度です 。
延長期間の算出方法
延長が認められる期間は「最大5年」ですが、無条件に5年延長されるわけではありません。延長期間は、「政令で定める処分(承認等)を受けるために、特許発明の実施をすることができなかった期間」に基づいて算出されます。
具体的には、以下の2つの日のうち「遅い方」を始期とし、承認日(または承認書到達日)を終期とする期間となります 。
- 特許権の設定登録日
- 臨床試験(治験)の開始日(治験計画届出日など)
ここでの重要なポイントは、特許権が設定登録される「前」に行われた臨床試験の期間は、延長の対象とならないということです。したがって、早期に特許を取得すればするほど延長対象期間が長くなる可能性がありますが、逆に特許査定が遅れると、その分延長できる期間が短縮されるリスクもあります。また、企業側の怠慢(デューデリジェンスの欠如)によって審査が遅延した期間については、延長期間から控除される場合があるため、規制当局への対応スピードも知財管理の一環として重要になります 。
延長登録出願のタイミング
延長登録の出願は、政令で定める処分(承認)を受けた日から「3ヶ月以内」に行わなければなりません。この期間は極めて短く、徒過した場合は救済措置が極めて限定的であるため、承認予測時期に基づいた事前の準備が必須です。また、本来の特許満了日が迫っている場合でも、承認が得られる見込みであれば、期間満了の6ヶ月前までにその旨を特許庁に申し出ることで、権利消滅を回避できる規定も存在します 。
延長登録の要件と「政令で定める処分」の解釈
延長登録が認められるためには、特許庁の審査基準を満たす必要があります。最大の要件は、「その特許発明の実施に、政令で定める処分を受けることが必要であったと認められること」です 。
対象となる特許と処分
対象となるのは、医薬品、農薬、体外診断用医薬品、再生医療等製品などです。特許の種類としては、物質特許だけでなく、製剤特許、用途特許、結晶特許なども対象となり得ます。ただし、医薬品の製造に使用される「中間体」や「製造装置」などの特許は、最終製品そのものの製造販売が規制されているわけではないという理屈から、原則として延長の対象外とされています 。
審査事項の同一性
審査においては、承認された医薬品が特許発明の技術的範囲に含まれていることが前提となります。具体的には、承認された医薬品の「成分、分量、用法、用量、効能及び効果」が、特許発明の構成要件と合致しているかどうかが審査されます。
例えば、特許が「特定の安定化剤を含む製剤」に関するものである場合、承認された医薬品がその安定化剤を含んでいなければ、当然ながら延長は認められません。しかし、後述する判例により、この「合致」の解釈については柔軟性が持たれるようになっています 。
オキサリプラチン事件とアバスチン事件が示した権利範囲
この制度において実務上最も大きな論点となるのが、「延長された特許権の効力範囲」です。通常、特許権の効力はクレーム全体に及びますが、延長された特許権は「政令で定める処分の対象となった物(その特定の用途)」についての実施にのみ効力が及ぶと規定されています(特許法68条の2)。この規定を厳格に解釈しすぎると、ジェネリック医薬品がわずかに成分や用法を変えるだけで特許侵害を回避できてしまい、制度の趣旨が没却される恐れがあります。
オキサリプラチン事件:「実質的同一」の法理
知財高裁大合議判決(オキサリプラチン事件)は、この問題に画期的な判断を下しました。判決では、延長された特許権の効力は、承認対象となった医薬品と「実質的に同一」な範囲に及ぶと示されました。
具体的には、承認された医薬品と相手方(ジェネリック等)の製品が、特許発明の技術的思想の観点から見て実質的に同一である場合、特許権の効力が及ぶと判断されます。これにより、単に添加剤が異なる程度の変更では特許回避が難しくなり、先発メーカーの保護範囲が実質的に確保されることとなりました 。
アバスチン事件:先行処分の影響
一方、アバスチン事件では、「以前に受けた承認(先行処分)」と「今回の承認」の関係が争点となりました。特許庁は、先行処分によって既に特許発明の実施が可能になっていた場合、新たな承認に基づく延長は認めないという立場をとっていました。
最高裁および知財高裁は、先行処分と今回の処分を比較する際、単に形式的な審査事項(用法・用量など)全体を比較するのではなく、「特許発明の種類や対象に照らして、医薬品としての実質的同一性に直接関わる審査事項」を比較して判断すべきであると判示しました。
つまり、新たな承認が、特許発明の観点から見て「新たな実施」を可能にするものであれば延長が認められますが、実質的に先行処分でカバーされていた範囲であれば延長は拒絶されるということです 。
日米欧の制度比較から見る日本の「キャップなし」の優位性
グローバル製薬企業にとって、日本、米国、欧州の制度差異を理解することは、世界的な製品ライフサイクル戦略を構築する上で不可欠です。特に、延長期間の上限に関する規定(キャップ制度)において、日本は欧米と大きく異なる特徴を持っています。
米国の「14-year cap」
米国(Hatch-Waxman法)では、特許期間の延長(PTE)について、「承認後の特許残存期間」と「延長期間」を合計して14年を超えてはならないという「14-year cap」が存在します。どれほど審査に時間がかかっても、市場に出てからの独占期間は最大14年に制限されるのです 。
欧州の「15-year cap」
欧州(SPC制度)でも同様に、最初の市場承認(Marketing Authorization)から15年を超えて独占権を行使できないという「15-year cap」が設けられています。また、SPC自体の期間も最大5年(小児用医薬品の場合は+6ヶ月)とされています 。
日本の制度的特異性
これに対し、日本には承認後の総独占期間に対するキャップ(上限)が存在しません。延長期間そのものは最大5年という制限がありますが、「承認時点で特許が残り何年あろうとも」、要件を満たせば最大5年が加算されます。
極端な例として、承認が非常に早く下り、特許期間がまだ15年残っている状態で5年の延長が認められれば、合計20年近い独占販売期間を享受できる可能性があります(特許満了日は出願から25年後)。これは、欧米の制度と比較して、日本の制度が特許権者(製薬企業)にとって非常に有利に働く可能性があることを意味しています 。
また、延長の「回数」についても違いがあります。欧州のSPCは、原則として1つの基本特許・1つの製品につき1回しか認められません 。しかし日本では、1つの特許に対して、異なる処分(例えば、新しい効能・効果の追加承認)に基づく複数の延長登録が認められる場合があります 。これにより、適応拡大を繰り返すライフサイクルマネジメントにおいて、日本市場では特許権による重層的な保護が可能となります。
ジェネリック参入阻止を見据えた戦略的ポートフォリオ
以上の制度的枠組みを踏まえ、製薬企業は開発の初期段階から緻密な特許戦略を練る必要があります。
特許網の多層化
物質特許の延長はもちろん最優先ですが、それだけでなく、製剤特許、用途特許、結晶特許など、周辺特許についても延長登録の可能性を検討すべきです。特に、物質特許が切れた後も、特定の製剤工夫や新しい用途に関する特許が延長されていれば、ジェネリックの参入障壁となり得ます。ただし、前述のアバスチン事件の教訓から、先行する承認によって後の延長が拒絶されないよう、特許のクレーム構成と承認取得の順序を戦略的に設計する必要があります。
明細書記載の充実
オキサリプラチン事件で示された「実質的同一」の範囲を最大限に活用するためには、明細書の記載が鍵となります。将来的に想定されるジェネリックの変更態様(塩の変更、添加剤の変更など)を予見し、それらが「技術的に等価」であることを主張できるような定義や実施例を明細書に盛り込んでおくことが重要です。特許権の効力は、最終的には明細書の記載に基づいて解釈されるため、出願段階での作り込みが15年後の収益を守ることになります 。
承認予測と期間管理
延長登録出願は時間との戦いです。治験の進捗状況を常にモニタリングし、承認が見込まれる時期を正確に予測する必要があります。特に、特許期間満了日が迫っている中での承認取得となる場合、期間満了の6ヶ月前までに特許庁へ「延長登録出願を行いたい旨の申出」を行う必要があります。この手続きを失念すると、承認が下りる前に特許が消滅し、延長の権利を失うことになります 。
結論
特許期間延長制度は、製薬企業の収益に直結する極めて強力なツールです。日本の制度は、欧米に見られるような「独占期間の総量規制(キャップ)」が存在しない点や、複数回の延長が可能である点において、イノベーターにとって有利な側面を持っています。しかし、その恩恵を享受するためには、複雑な期間計算、厳格な出願期限の遵守、そして判例法理に基づいた高度な権利解釈が求められます。
研究開発部門、薬事部門、そして知財部門が三位一体となり、製品のライフサイクル全体を見据えた戦略を実行することこそが、激化するグローバル競争を勝ち抜くための鍵となるでしょう。
参考文献
特許庁, “特許法第67条 存続期間の延長 審査基準 ガイドライン”
特許業務法人 津国, “特許権の存続期間の延長制度に関する特許法の改正”, Newsletter No.2, 2020.
特許庁, “審査基準 第IX部 特許権の存続期間の延長登録”
特許庁, “審査基準 第IX部 特許権の存続期間の延長登録 (ハンドブック)”
日本知財学会, “オキサリプラチン事件 知財高裁 判決 解説”, 知財管理.
日本製薬工業協会, “オキサリプラチン事件 知財高裁 判決 解説”, 委員会報告.
日本製薬工業協会, “オキサリプラチン事件 知財高裁大合議 判決 判旨 延長された特許権の効力”
知的財産高等裁判所, “アバスチン事件 知財高裁 平成25年(行ケ)第10195号 判決要旨”
契約ウォッチ, “特許法施行令第3条 期間の計算 延長登録”
Drug Patent Watch, “Patent term extension calculator step-by-step expert guide”
Drug Patent Watch, “Calculating the regulatory review period for patent term extension”
American Economic Association, “US patent term extension ’14 year cap’ calculation materials”
FDA, “Determination of Regulatory Review Period for Patent Term Extension”
Duke University Libraries, “US patent term extension ’14 year cap’ calculation research”
Drug Patent Watch, “Global exclusivity divergence Hatch-Waxman PTE versus European SPC extensions”
EFPIA, “Annex to public questionnaire informing the European Biotech Act”
Wolters Kluwer, “EU Biotech Act: The coming EU IP shake-up”
AMR Industry Alliance, “Response to the Council’s position on the transferable exclusivity vouchers”
Managing IP, “SPC decision spells bad news for second medical use”
富国生命投資顧問, “医薬品 2010年問題 特許クリフ 売上影響”
Pharma-com, “Drug Intellectual Property Series 4: Patent Term Extension”
European Patent Office, “Protection beyond 20 years: SPCs and PTEs”
SIKS, “Patent Term Extension Comparison”
Managing IP, “Q&A: Patent term extension at a glance”
Alacrita, “Pharmaceutical Patent Term Extension: An Overview”
知的財産高等裁判所, “アバスチン 知財高裁 平成25年(行ケ)第10195号 判決 判示事項”
古賀法律事務所, “パクリタキセル 最高裁 判決 判示事項 解説”
山水国際特許事務所, “アバスチン 知財高裁大合議 判決 判示事項 解説”
(この記事はAIを用いて作成しています。)